一、适用范围
本指南适用于进口体外诊断试剂首次注册审批的申请和办理。
二、办理依据
《医疗器械监督管理条例》(**令第650号)第十一条:申请第二类医疗器械产品注册,注册申请人应当向所在地省、自治区、直辖市人民政府食品药品监督管理部门提交注册申请资料。申请第三类医疗器械产品注册,注册申请人应当向**食品药品监督管理部门提交注册申请资料。向我国境内出口第二类、第三类医疗器械的境外生产企业,应当由其在我国境内设立的代表机构或者指定我国境内的企业法人作为代理人,向**食品药品监督管理部门提交注册申请资料和注册申请人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。第二类、第三类医疗器械产品注册申请资料中的产品检验报告应当是医疗器械检验机构出具的检验报告;临床评价资料应当包括临床试验报告,但依照本条例第十七条的规定免于进行临床试验的医疗器械除外。
三、受理机构
国家食品药品监督管理总局医疗器械技术审评中心
四、决定机构
国家食品药品监督管理总局
五、办事条件
申请人应为境外生产企业,且该医疗器械已在注册申请人注册地或者生产地址所在国家(地区)已获准上市销售。
六、申请材料
(一)申请材料清单
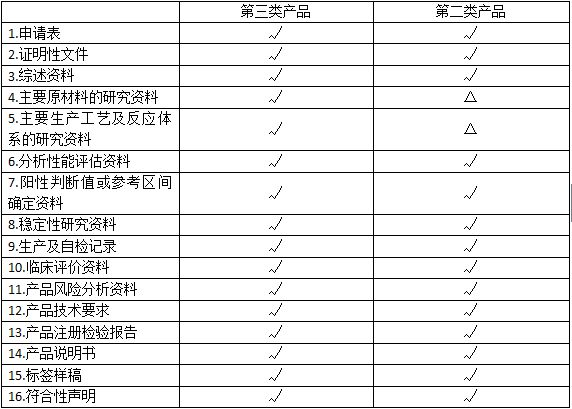
注:申请人应根据产品类别按照上表要求提交申报资料。
√:必须提供的资料。
△:注册申请时不需要提供,由申报单位保存,如技术审评需要时提供。
境外申请人应当提交:
1.申请人注册地或生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件和可以合法生产申报产品的资格证明文件,如该证明文件中有产品类别描述,其类别应当覆盖申报产品。
2.申请人注册地或者生产地址所在国家(地区)未将该产品作为医疗器械管理的,申请人需要提供相关证明文件,包括注册地或者生产地址所在国家(地区)准许该产品上市销售的证明文件。
3.申请人符合注册地或者生产地址所在国家(地区)医疗器械质量管理体系要求或者通过其他质量管理体系认证的证明文件。
4.申请人在中国境内指定代理人的委托书、代理人承诺书及营业执照副本复印件或者机构登记证明副本复印件。
(二)申请材料提交
申请人可通过窗口报送、邮寄等方式提交材料。
七、办理基本流程

八、办理时限
1.受理:5个工作日
2.技术审评:60个工作日完成二类医疗器械注册审评,90个工作日完成三类医疗器械的注册审评。
3.行政许可决定:20个工作日
4.批件制作和送达:10个工作日
本《进口体外诊断试剂首次注册审批指南》由北京鑫金证国际技术服务有限公司医疗器械注册部人员根据国家食品药品监督管理总局发布的医疗器械注册法规将涉及到医疗器械注册申报企业的部分内容进行整理,更为直观展示,方便学习和使用。










 沪公网安备 31011502003242号
沪公网安备 31011502003242号